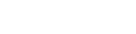
来自澳大利亚眼科研究中心的Tom Edwards(左)正在实施一种基于病毒载体的基因疗法。Credit: Mathew Lynn/CERA
在1972年一篇具有里程碑意义的论文1中,医生Theodore Friedmann和生物化学家Richard Roblin预见了操纵DNA来帮助治疗人类遗传疾病的前景。但他们警告说,在该领域能深入掌握细胞中的遗传过程、它们与疾病的关系以及治疗的潜在副作用之前,应当限制使用。
在接下来的数十年间,科学家们开始消除这些障碍,并于1990年取得重大突破:一名患有严重联合免疫缺陷病的4岁女孩在临床试验中得到成功治疗2。这揭开了充满希望和大胆承诺的十年的序幕。
然而这一早期成就只是昙花一现,接下来迷宫般的技术挑战出现了。一种常见的基因治疗方法是将健康的基因传递给基因库中只有缺陷拷贝的细胞。一旦进入,治疗基因就会指示细胞制造功能性蛋白质而不是有缺陷的蛋白质。一个困难在于确保治疗基因对准正确组织中的正确细胞,并穿梭到数百万个而不仅仅是几个这样的细胞中,并且不会破坏邻近基因的工作顺序。澳大利亚悉尼皇家阿尔弗雷德王子医院细胞和分子治疗科主任、临床血液学家John Rasko说,另一个障碍是确保插入的基因产生足够的蛋白质来完成这项工作。“我们拥有可以将基因递送到细胞中的工具,但我们无法实现能有治疗效果的高效率递送。”他说。
治疗基因还需要搭载在运载工具中,这种运载工具可以悄无声息地滑入细胞,而不会引发来自最强大的守门人——免疫系统——的有害甚至致命反应。
尽管存在这些挑战,科学家们还是取得了更多进展。但在1999年,一名18岁的试验参与者在接受一剂针对鸟氨酸氨甲酰转移酶(OTC)缺乏症的实验性基因治疗后不久死于肝衰竭。这是一种罕见的代谢紊乱,阻止身体分解氨。这场悲剧在整个领域引发了冲击,迫使其重新进入评估。Rasko说,“在这之后,基因治疗进入了‘黑暗时代’”。然而,更可靠的进展终于开始出现。
——— 作为载体的病毒 ———
历经高潮和低谷,病毒仍然是将治疗基因传递到难以到达的细胞的首选信使。在自然界中,病毒是狡猾的细胞劫持者,可以引发毁灭性的疾病爆发和疫症流行。它们穿透细胞并欺骗宿主复制其基因的能力,也使之成为基因治疗的完美工具。西雅图华盛顿大学研究肌肉萎缩症病毒载体基因疗法的Julie Crudele说,经过数百万年的进化,病毒比其他基因治疗载体(例如合成纳米颗粒)具有更强大的优势。“他们生来就是为了到达细胞,”她说,“我们只要利用它们的天性。”
在过去十年中,消除失败阴影的工作已经开始取得回报,预示着一个乐观时代的到来,特别是在遗传性眼病的治疗方面。全世界有近300项临床试验在研究基于病毒载体的基因疗法。其中大约一半使用改良的腺相关病毒(AAV)——一种经过充分研究,不会引起人类疾病的小型病毒。这些病毒是基因治疗的理想选择,因为它们的目标组织多种多样,在大多数情况下仅触发轻微的免疫反应,从而使它们成为安全、多功能和高效的治疗工具。
——— 揭示更清晰的视野 ———
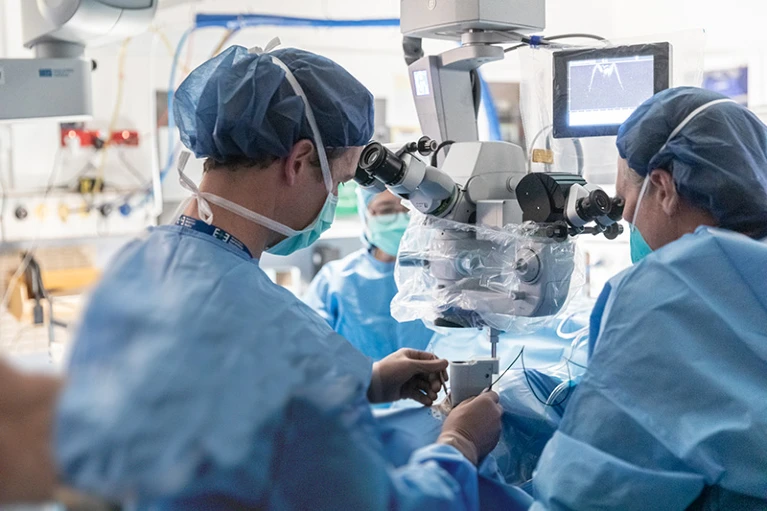
基因治疗皇冠上最近的一颗明珠出现在遗传性视网膜疾病领域,这种疾病导致全世界超过200万人视力下降和失明。佛罗里达州盖恩斯维尔玻璃体视网膜联合会的外科医生Christine Kay说:“基因疗法和眼科领域出现了重大突破。”眼睛具有免疫赦免,这意味着它们会限制局部免疫和炎症反应以保持视力,从而使它们成为理想的基因治疗目标,因为它们免受免疫引起的炎症的破坏力,并且病毒可以潜入而不引起人体警钟的反应(见“病毒载体”)。
2017年,voretigene neparvovec-rzyl(商品名为Luxturna)成为第一个获得美国食品和药物管理局(FDA)批准的基因替代疗法。这是治疗遗传性视网膜疾病的首批疗法之一。这种基因疗法由位于宾夕法尼亚州费城的一家生物技术初创公司Spark Therapeutics开发,是一种针对RPE65基因有害突变的一次性治疗,这种突变会导致严重的视力丧失。该药物依靠AAV载体将基因的工作副本直接传递到视网膜细胞中,并在视网膜细胞中指挥制造将光转化为电信号的蛋白质。该疗法也已在欧盟和澳大利亚获得批准。“这对该领域来说是一个福音。”墨尔本澳大利亚眼科研究中心视网膜基因治疗研究小组的负责人Thomas Edwards说。
投资者和大型制药公司正在迎头赶上。在2020年之前的两年里,包括诺华、罗氏和拜耳在内的七家制药巨头以接近或超过10亿美元的价格收购了开发基于病毒载体的基因疗法的小型生物技术公司。到2027年,全球基因治疗市场的收入预计将从53.3亿美元跃升至198.8亿美元。在马萨诸塞大学医学院专门研究病毒载体的基因治疗研究人员Guangping Gao表示,近年来临床试验的积极效果,为患者和研究人员带来了他们迫切需要的信心提升。“这种信心最终会转化为更多的投资。”
Edwards说,Luxturna的里程碑为解决由多个基因所致的更常见眼部疾病打下了基础。“遗传性视网膜疾病是一个起点,因为它们适合基因治疗方法,”他说。“我们现在正在看到这项技术被应用于更常见的疾病,这些疾病在遗传上更为复杂。”
其中一种疾病是年龄相关性黄斑变性,在全球这是视力丧失的一个主要原因。GT005是伦敦Gyroscope Therapeutics开发的一种基于AAV的基因疗法,旨在针对干性年龄相关性黄斑变性。GT005的基因有效载荷旨在通过促进补体因子I(CFI)的产生来恢复平衡。补体因子I(CFI)是一种蛋白质,常用于调节补体系统(人体免疫库的一个方面,当它变得过度活跃时会驱动与年龄相关的黄斑变性)。提高 CFI 的产生可减少与过度活跃的补体系统相关的炎症,从而减少眼睛中破坏视力的血管数量。美国、欧洲和澳大利亚正在进行I/II期试验。领导澳大利亚试验的Edwards说,如果被证明是安全有效的,基于AAV的基因疗法可能会给患有这种曾经无法治愈的疾病的患者带来希望。
——— 眼睛,以及更多 ———
尽管挑战依然存在,但除了眼科之外的疾病治疗也在取得进展。2019年,FDA批准了onasemnogene abeparvovec(商品名为Zolgensma),这是一种基于AAV的脊髓性肌萎缩症基因疗法。该疗法由诺华基因疗法公司开发,每剂费用为200万美元,可在两岁以下的患者中用健康基因替代致病基因。迄今为止,已有超过2300名患者接受了Zolgensma治疗。但在8月,俄罗斯和哈萨克斯坦的两名儿童在接受剂量约一个月后死于急性肝衰竭,尽管他们接受了药物治疗以降低副作用的风险。在死亡事件发生后发布的一份声明中,诺华公司表示,急性肝功能衰竭是Zolgensma的“已知副作用”,但补充说将更新其标签以反映已报告的死亡事件。该公司还表示坚信该药物“总体收益大于风险”。
脊髓性肌萎缩症并不是基因治疗名单上唯一的神经肌肉疾病。仅在美国就有五项试验,杜氏肌营养不良症也成为治疗的目标。2019年,马萨诸塞州查尔斯敦的生命科学公司Solid Biosciences在几名参与者出现肝损伤和血小板计数低等不良副作用后暂停了SGT-001基因治疗的I期和II期试验。但在改进制造工艺后,该公司在3月份报告称三名接受高剂量治疗的患者的运动和肺功能有所改善,而没有出现之前的有害副作用。
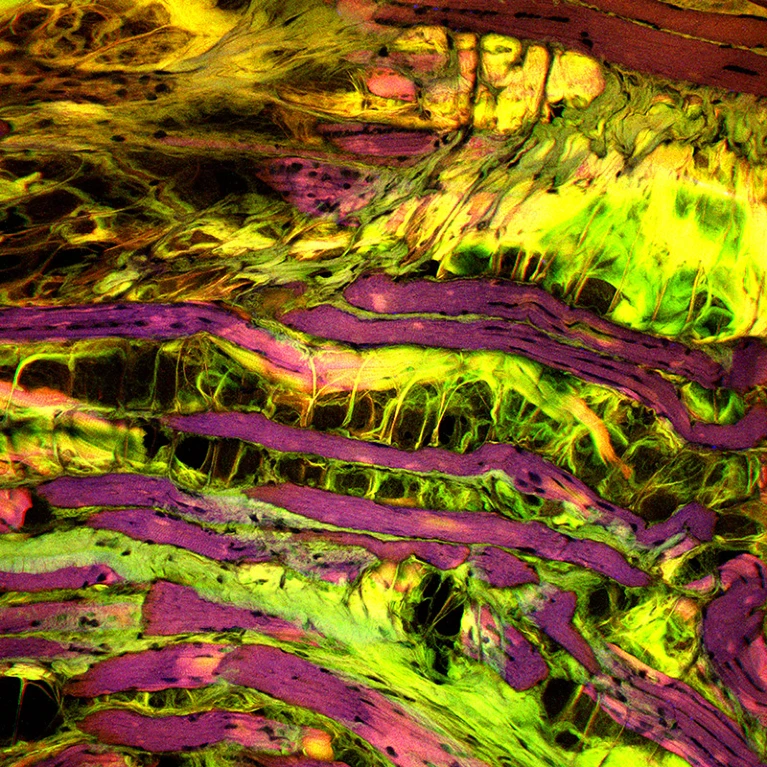
受肌营养不良症影响的肌肉组织切片的显微图像。来源:Patrick Landmann/SPL
用基于AAV的基因疗法治疗肌肉疾病是一个精细的平衡;需要大量剂量才能产生治疗效果,这会增加不良反应的可能性,Crudele说。“你必须击中每一个细胞,这意味着你必须施以非常大的剂量。”
一些研究人员正在通过调整AAV载体来解决这个问题,以更有效地将工作基因传递给细胞,从而减少对大剂量的需求。2021年,研究人员对AAV载体进行了基因改造3。当他们将每种载体注射到患有杜氏肌营养不良症的小鼠体内时,他们发现其中一种经过修饰的载体到达肌肉组织的效率是标准载体的十倍,即使在低剂量下也能保持有效。
——— 黑暗时代终结? ———
血友病——一种影响全球超过一百万人的遗传性凝血障碍——几十年来一直在基因治疗队列中占据首位。它通常通过定期注射来治疗,以替代缺失的凝血蛋白。但高昂的费用阻碍了发展中国家的患者接受治疗,而大约80%的血友病病例都发生在这些国家。“大多数人会因为得不到治疗而过早去世。”伦敦大学学院专门研究血友病和其他血液疾病基因治疗的Amit Nathwani说。“对于这些人来说,基因疗法会改变局面。”目前至少有12项临床试验探索基于AAV的基因疗法以治疗A型和B型血友病。
Nathwani和他在英国斯蒂夫尼奇的生物技术公司Freeline Therapeutics的团队正在美国及欧洲领导一项名为FLT180a(verbrinacogene setparvovec)的B型血友病基因疗法试验。该疗法在合成的AAV载体内提供受影响基因的功能版本。在一篇2022年的论文4中,90%的试验参与者的凝血蛋白水平在接受剂量两年后仍然很高,这意味着他们不再需要定期注射蛋白。“如果你在10到12年前问,B型血友病患者是否能达到正常范围,我会说不能。”Nathwani说。“我们已能推动前沿的进步。”
随着FLT180a等新兴疗法的研发,对于患有衰弱性遗传疾病——从血液疾病到眼部疾病——的人们来说,未来开始显得美好起来。Rasko说,尽管基因疗法在成为常规治疗之前还有一段路要走,但批准和临床试验的浪潮表明,基因疗法的黑暗时代可能终于结束了。“它将止步于此。”
Gemma Conroy 是澳大利亚悉尼的一名自由撰稿人。
1. Friedmann, T. & Roblin, R. Science 175, 949–955 (1972).
2. Blaese, R. M. et al. Science 270, 475–480 (1995).
3. Tabebordbar, M. et al. Cell 184, 4919–4938 (2021).
4. Chowdary, P. et al. N. Engl. J. Med. 387, 237–247 (2022).
自然指数 - 生物医药
Nature Index 自然指数
自然指数是一个包括了作者单位信息和机构关系的数据库,它追踪发表在82种高质量自然科学期刊上的科研论文。这些期刊均由在职科学家所组成的独立小组选出。
自然指数提供机构和国家/地区所发表的论文的绝对计数和份额,由此可显示全球高质量科研产出及合作的情况。自然指数数据会定期更新,并依照知识共享协议,在指数网站natureindex.com上对外发布最近十二个月的数据。该数据库由施普林格•自然编制。
自然指数主要采用论文数和份额两种科研产出计算方法:
•论文数(Count)- 以前被称为“论文计数 (article count/AC)”,是指一篇文章不论有一个还是多个作者,每位作者所在的国家/地区或机构都获得1分。这就是说一篇论文能为多个国家/地区或机构带来一个分值。
•贡献份额(Share)- 为了统计一个国家、地区或机构对某篇论文的贡献,并确保不会重复计算,自然指数还使用Share(份额),以前被称为“分数式计量(fractional count/FC)”,它计算的是每篇论文作者的贡献份额。一篇文章总分值为1,每位作者被认为对论文有相同的贡献,分值在所有作者中平均分配。例如,一篇论文有10位作者,则每位作者的得分为0.1。对于隶属于多个机构的作者,其贡献份额则在各机构间平均分配。机构总的份额分值是将与之有关联的各个作者的份额相加得出的。国家/地区的份额计算过程与之相似,尽管由于某些机构拥有海外实验室而将其计入所在国家/地区,这令情况变得复杂。
•合作分值(collaboration score) - 由一个科研机构或国家所有双边合作方的贡献份额相加而得。